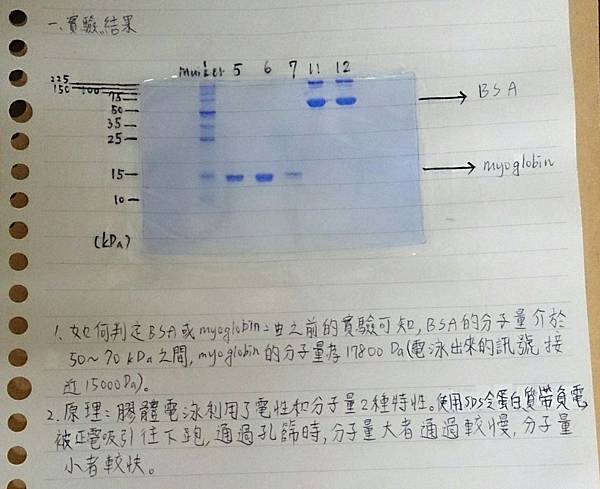
實驗結果:
1.如何判定BSA或myoglobin:由之前的實驗可知,BSA的分子量介於50~70kDa之間,myoglobin的分子量為17800Da (電泳出來的訊號接近15000 Da)
2.原理:膠體電泳利用了電性和分子量兩種特性。使用SDS令蛋白質帶負電,被正電吸引往下跑,通過孔篩時,分子量大者通過較慢,分子量小者較快。
3.問題與討論:
(1)做膠:我們製作下膠失敗6次,前5次上緣總是傾斜,後來發現原因為架膠的器材下方黑色海綿不平整,才導致這個結果;更換器材後解決。
(2)Band粗細及染色:編號5.6.7的蛋白質訊號強度不如11.12,推測為純化不夠,濃度沒有編號11.12高,故顏色較淡也較細。
(3)雜訊:在15kDa及50~75kDa其他處亦有訊號(如編號6的band有明顯暈開),可能是管柱層析無法精確排除其他蛋白質所造成。
4.注意事項:
A.架膠時:
(1)玻璃片可先用酒精擦拭,方便之後取下膠體
(2)玻璃必須放在正確位置後方可鎖緊,以免玻璃夾碎防
(3)卡楯需檢查是否卡緊,防止膠體或buffer外漏
B.製膠時:
(1)30% acylamide solution 具有神經毒,實驗環境應通風,傾倒時亦須小心謹慎
(2)TEMED和10%APS最後才加入避免膠體過早凝結,在加入上述兩種溶液前須先將pipetment與tips準備好,以利動作迅速
(3)在下膠凝固前可用水將上緣壓平
C.電泳時:
(1)不要在兩側load sample,因為干擾較多,訊號會不精確
(2)Buffer的量要足夠,避免斷電
(3)電泳槽的正負極務必正確,一但接錯便不可挽回,須重做實驗
(4)電流須視膠片調整(1片25mA;2片50 mA)
(5)通電時,須將提示牙齒位置的塑膠片取下
(6)電泳至距底部1公分時斷電
D.封膠時:
(1)使用大量的水,避免氣泡產生,尤其膠體附近更要注意
(2)蓋上凝膏紙往後折平整,可避免檢查是否有氣泡時造成干擾
--------------------------------------------不正經分隔線---------------------------------------
那個時候架膠架到快中風◢▆▅▄▃崩╰(〒皿〒)╯潰▃▄▅▇◣
居然是那個架子的問題= =
想說奇怪我們四個人怎麼做起來都一樣歪
這個實驗做好久啊
算了一下我們這組在實驗室關了快6個小時
隔壁班更慘烈,有一組做到天黑_(┐「ε:)_
原稿














 留言列表
留言列表

